みなさん、こんにちは。
JOMDDで経営企画と事業開発全般を担当している石倉です。
今回は、表記のシリーズの第2弾です。前回第1弾では、「医療機器の事業計画を立案する際の鍵となる要素・マイルストーン」についてご紹介しました。
弊社も様々な領域の医療機器シーズのお話を頂く機会が増えてまいりましたが、弊社が関与させて頂けるか検討する際に重要視する指標の一つが薬事規制になります。今回は、この薬事規制が先般ご紹介した「新産業・デジタルヘルス領域の勃興」に対してどのような影響を及ぼしているか、にフォーカスしたいと思います。
■事例:デジタルヘルスにおける薬事戦略
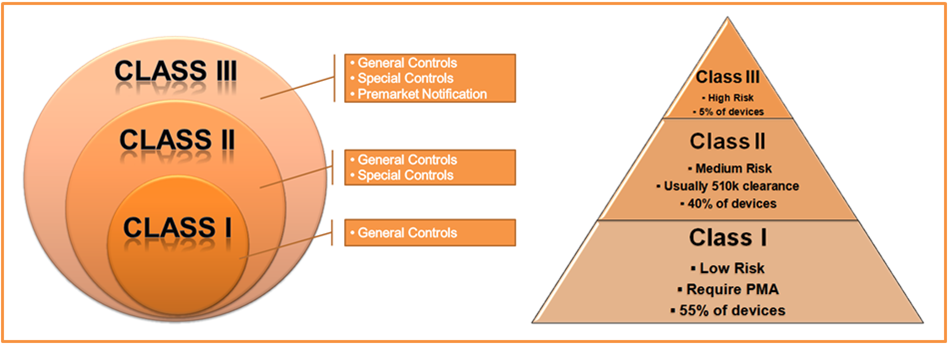
引用元:Mastering and Managing the FDA Maze, http://fda.dirkjanswagerman.nl/
新しい医療機器シーズに出会うと、まずその製品がどのクラス分類(Class III/Class II/Class I)に分けられるか精査する必要があります。
FDA: Classify Your Medical Device
http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/Overview/ClassifyYourDevice/
そして、そのクラス分類に応じてどのような薬事戦略が必要になるか、どの程度のデータが求められるかを判断します。また、同じクラス分類に属する医療機器でもかかる開発期間や工数が同じとは一概には言えません。
米国では、FDAが2013年9月にMMA(Mobile Medical Applications)というガイダンスをリリースしました。
http://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/ConnectedHealth/MobileMedicalApplications/ucm255978.htm(引用元のリンク切れのため、2018年3月に該当ULRへのリンクを削除致しました)
このガイダンスがリリースされる前は、このMMAによりマーケットに出ている多くの医療関連アプリが薬事規制の対象になるとみていた専門家も多くいましたが、医療機器に該当しない余地を多く残した規制となりました。特に、承認済みの医薬品に対するアドヒアランス(服薬コンプライアンス)が低い領域に対しては、むしろFDAは積極的な姿勢も示し(=薬事規制しない)、国全体の医療システムの問題点に対してmHealth/デジタルヘルスにより補完させようとする意図が感じられるものとなりました。
mHealth/デジタルヘルス領域は、主に以下の4つのカテゴリーに分けられますが(※1)、この中でもっとも急成長を遂げているエリアは、#3 Workflow & Productivityです。一般向けの医療情報サービスではなく、病院内の情報管理であったり、民間保険会社内の情報管理であったりと各組織内で少しずつITの導入が進んできています。

※1:Enterprise Management ITはFDAの直轄下ではないが、幾つかの規制が設けられているため、上記の図のような区分分けがなされている。
一般的に、これまで医療機器に一切関与してこなかった方からは、FDA対応というと大きな障壁であるように思われることがあります。しかし、適切な臨床POC(Proof-Of-Concept)の取得・製品仕様決定・データマネジメントを行えば、薬事承認取得はむしろ大きなレバレッジとして用いることができます。私の留学時代の同期で大手ヘルスケアVCのCanaan Partnersのプリンシパルを務めるPapanek氏も以下で同様に自身の見解を述べていました。
How Wearable Startups Can Win Big In The Medical Industry
http://techcrunch.com/2015/02/19/how-wearable-startups-can-win-big-in-the-medical-industry/
日本でも、昨年11月に「医薬品医療機器等法」(改正薬事法)にて医療機器に関する条項が医薬品等から分離され、医療機器の特性を踏まえた制度が構築されました。この際に、医療機器の規制対象に「単体ソフトウェア(医療機器プログラム)」が追加され、医療産業全体から高い関心が寄せられています。
薬事規制はその後のマーケティング戦略にも大きな影響を及ぼしますので(製品のプライシング、商流の限定化)、自社の開発する医療IT/デジタルヘルス/mHealth(モバイルヘルス)製品がどのカテゴリーに属することになるか、開発の初期段階で見極めておく必要があります。そして、その戦略に合わせた製品仕様の確定/開発計画の策定/資金調達の実行を進めることで円滑なPDCA実行が可能となります。
それではまた次回。