美しい桜の季節が終わろうとしています。代表の内田です。皆様お元気にお過ごしでしょうか。
さて、今回は月初に米国食品医薬局(Food and Drug Administration, FDA)から出されたドキュメントについて触れてみたいと思います。
はじめに
近年、ソフトウエアが単体で医療機器として機能する「プログラム医療機器」(Software as a Medical Device, SaMD)が世界中で見受けられます。さらには人工知能(artificial intelligence, AI)や機械学習(machine learning, ML)が搭載されたプログラム医療機器の開発も行われるようになりました。AI/MLを搭載したプログラム医療機器の中には、使用を通じて持続的にデータを収集・分析し、その結果をアップデートして機能に反映することで、絶えず性能が変化するものもあります。こうしたプログラム医療機器をどのように政府関係当局が規制をするのか。これは医療機器業界で近年とても注目されているトピックの1つです。
これまでもFDAは2017年7 月に “Digital Health Innovation Action Plan”² を発表し、世界に先駆けて新しい医療分野であるデジタルヘルスに対して積極的にコミットしていくことを表明しました。この活動の一環として、2019年1月に58ページに及ぶ「The Software Precertification (Pre-Cert) Program」³ を発表し、この中でFDAは、プログラム医療機器に対する規制の考え方をいくつか紹介しました。Total Product Lifecycle Approach(TPLC)がその1つで、TPLCではいわゆる従来の医療機器審査に必要な基本的な事項の審査と、プログラム自体についての審査、2つの側面で速やかに審査すること、そして、実際に社会実装した後も、適宜製品の有効性や安全性をモニターしていくことを、一連のパッケージとして説明しています。いわゆるPDCAサイクルのように、社会実装後も必要があれば製品をアップデートして再度審査のプロセスを回すという具合で、製品を世に出すまでの審査から、製品のライフサイクルを考えるという方向性です。
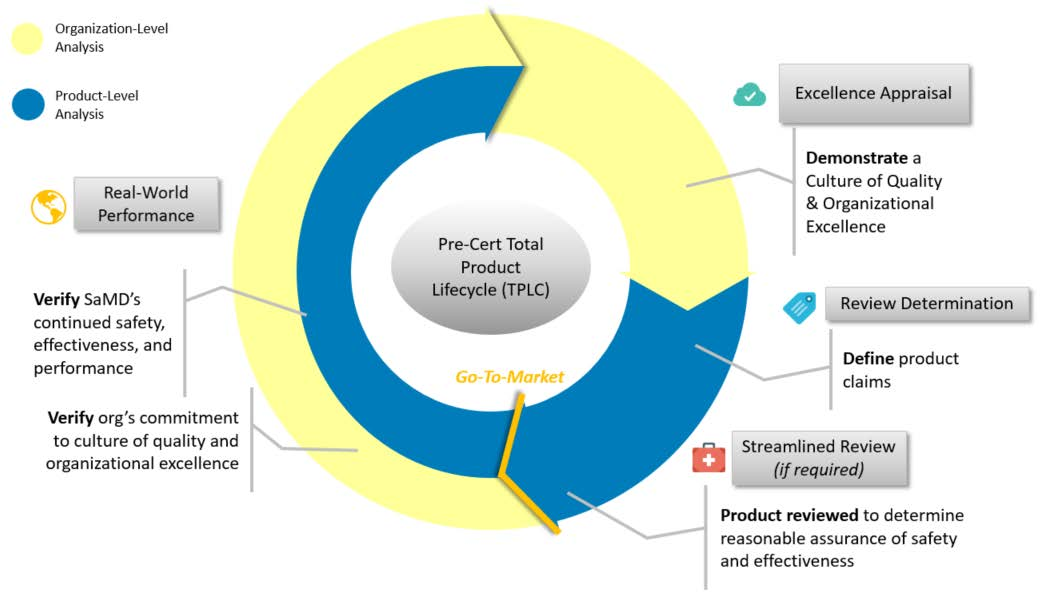
とはいえ、実際にこれまでFDAに承認されたプログラム医療機器のほとんどは、時々刻々と変化しうるプログラムだとしても、基本的には一旦プログラムのアップデートをロックして、固定した時点のアルゴリズムをプログラムとした製品について、審査を行い承認するというスタンスでした。ところが、今回のディスカッションペーパーではさらに一歩踏み込み、アルゴリズムをロックしないプログラム医療機器に対してどのように今後取り組んでいくのかについての考え方を示しており、大変画期的であると感じています。
Good Machine Learning Practice (GMLP)
FDAはこれまでにも、治験の実施ではGood Clinical Practice、製造の品質管理についてはGood Manufacturing Practiceというような形で規制をまとめてきました。今回のディスカッションペーパーではGood Machine Learning Practice(GMLP)という言葉を用いてプログラム医療機器の品質管理をまとめようとしています。これからは「GMLP」というのが新しい薬機キーワードになりそうな予感です。GMLPでは使用データが妥当か、使用目的やプログラムのアップデートの仕方が合理的か、そして用いているアルゴリズムが患者にとってあまりにもブラックボックス化されていないかというような視点で規制に臨むようです。
プログラム医療機器のアップデートには3つの種類があることも述べられています。3つとは、1)機器としての性能(performance)、2)用いられるデータ(inputs)、そして3)使用目的(intended use)です。今後、時々刻々と変わるプログラム医療機器のアップデートについてはこの3つの視点から捉えられていくことになります。
今回のディスカッションペーパーでは下図(図2)が用いられています。この図を読み解くと、FDAがどのようにAIや機械学習を利用したプログラム医療機器の規制を考えようとしているかがわかる気がします。
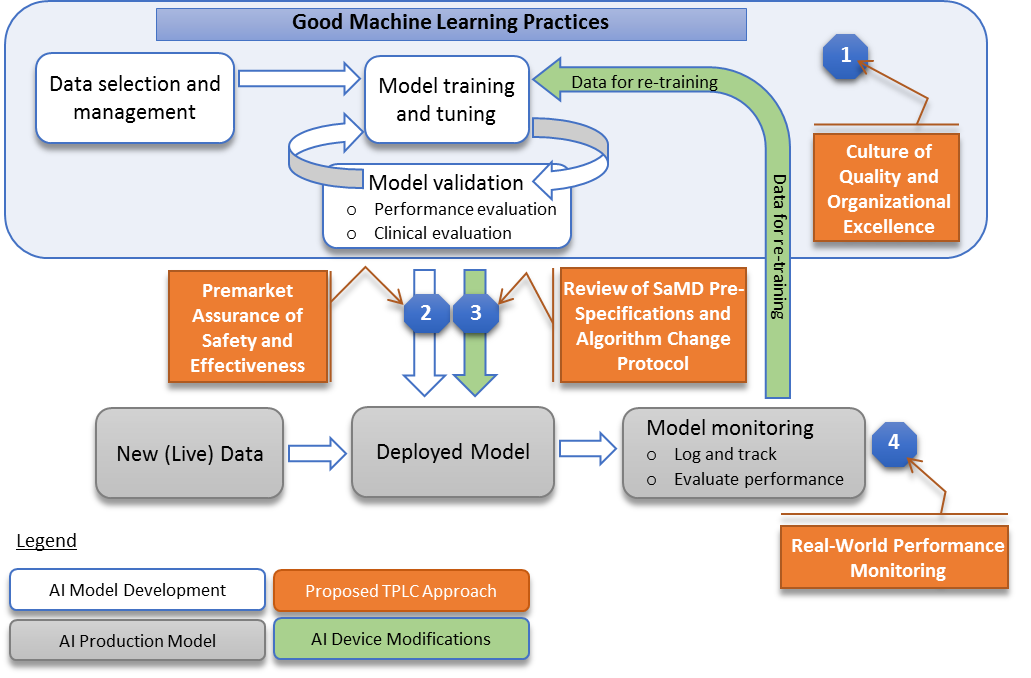
(FDA, “Proposed Regulatory Framework for Modifications to Artificial Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD) – Discussion Paper and Request for Feedback”¹, April 2019, 8p, “Overlay of FDA’s TPLC approach on AI/ML workflow”より)
色々な製品が承認されていくにつれ、以前に承認されたものに近いプログラムをひとくくりにして審査した方が効率的ということになります。このために今回FDAはSPSとACPを定義しました。
SPSは、プログラム医療機器がどんな観点で時間とともに変化しうるのか予め範囲として考えるというくくりで、ここでいうspecificationsとは上述の、1)性能、2)用いるデータ、3)使用目的の3つ(アップデートで変わりうるもの)に分けて考えることになります。
ACPは、変化しうるSPSがどんな要素やプロセスで変わりうるのかを定めるもので、機械学習のモデル、データ収集・データマネジメントの方法や、ソフトウエアのバリデーション法などを指します。SPSは機器の外側部分、ACPは内側部分と考えてもよいかもしれません。
そして、審査の対象となるプログラム医療機器のSPSやACPが、これまで承認された医療機器と同じかどうか、自身の承認されたSPSやACPと同じかどうかという切り口から、新規医療機器に該当するか、510kかそれともPMAかを分けていこうというものです(図3)。
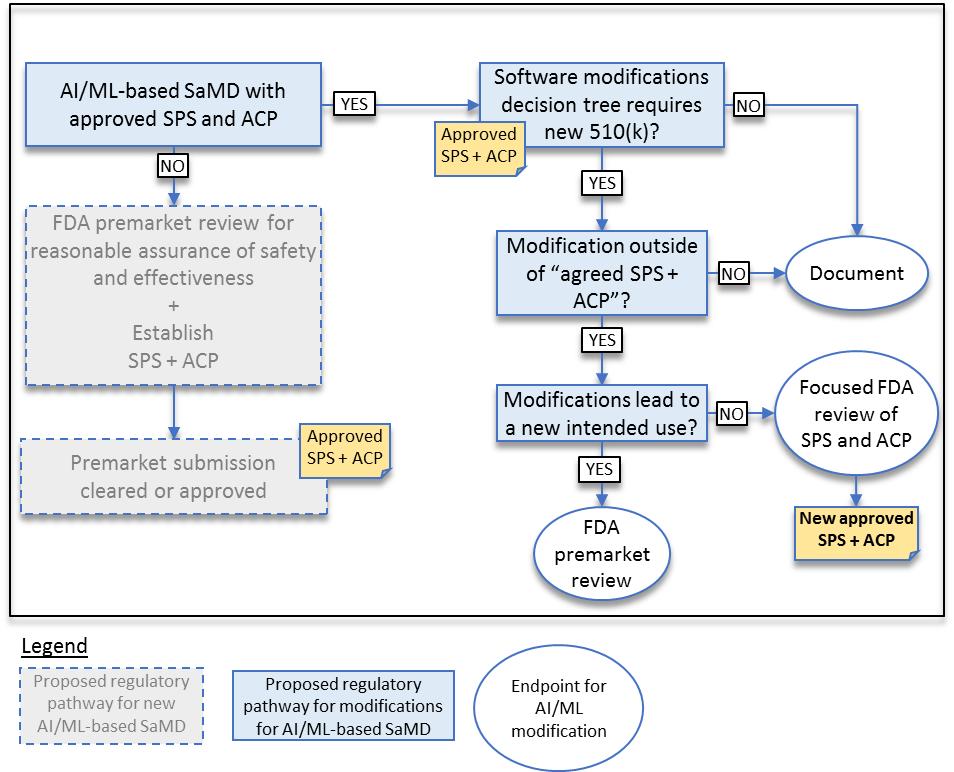
(FDA, “Proposed Regulatory Framework for Modifications to Artificial Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD) – Discussion Paper and Request for Feedback”¹, April 2019, 13p, “Approach to modifications to previously approved SaMD with SPS and ACP.”)
今回のディスカッションペーパーの中で、FDAは3つの具体例を挙げてくれました。
・ SPS:2つの項目が変わりうる想定
-異なる患者背景でも適切に応用できるように、リアルワールドデータとの比較からアルゴリズムを強化する
-病状悪化を検知する感度を維持あるいは向上させつつ、疑陽性アラームを少なくする
・ ACP:データベース、添付文書の記載、要求される性能と統計学的解析計画の整合性が主なポイント
・ 変更(プログラムの変化)シナリオ1A:SPSとACPは変えないまま性能が向上(type i modification)
-プログラムのアップデートに用いたデータセットとは別のデータセットを用意してバリデーションした結果、感度を維持したまま疑陽性アラームが減ったことを確認。このため、添付文書の記載上をアップデート(疑陽性が減った旨追記または数字の上書きなど)し、ユーザーにも周知(宣伝)。
-FDAの審査は不要!
・ 変更シナリオ1B:性能の向上と適応のアップデート-SPSとACPが変わる(type iii modification)
-データを追加し、アルゴリズムを変化させた結果、感度と疑陽性アラームが変わらないものの、病状悪化を15分前に予測できるプログラムにアップデートしたい。これは新しい機能で、患者のデータ解析法や性能などが明らかに異なる。これを添付文書に記載し、適応も変更したい。
-FDAの審査が必要!
・ SPS:2つが変わりうる想定
-リアルワールドデータ(使用の積み重ね)によりアルゴリズムを強化させ、感度・特異度を向上させる
-類似する他のスマホが使えるか使えないかを判断させるために、リアルワールドデータを用いて異なるスマホの画像認識性能をモニターする
・ 変更シナリオ2A:SPSとACPは変えないまま性能が向上(type i modification)
-リアルワールドデータを用いた機械学習から感度・特異度を向上。この際バリデーションの方法も以前と同じ。添付文書の記載上をアップデート。
-FDAの審査は不要!
・ 変更シナリオ2B:データインプットを変える(type ii modification)がSPSとACPは変えず
-新たに2つのスマホにおいてこのアプリが使えるかどうか、画像認識のバリデーションを一つ目のスマホと同じバリデーション法で確認。性能が変わらないことを確認。添付文書の記載上を当該2つのスマホが使える旨アップデート。
- FDAの審査は不要!
・ 変更シナリオ2C: 適応のアップデート-SPSとACPが変わる(type iii modification)
-同じアプリを患者向けにリリース。必要あれば皮膚科受診をという形に。
-患者向けにすることによる新たなリスクが既存のSPSとACPでは判断できないことから、FDAの審査の対象!
放射線科医向けで作られたこのアプリの性能をSPSとACPを変えずにアップデートし、より正確さが増したとします。これをベッドサイドの看護師が使用するようにしたアップデートはtype ii modificationとして審査は不要とします。他方、同様のアルゴリズム作成方法やバリデーション法ですが、今度は肺炎の診断をするものとして開発したとします。こちらはtype iii modification のため審査の対象となります。
AI/MLなどの導入により、医療に大きな変革が起きると考えられている今、規制当局が時々刻々と変化するようなプログラム医療機器をどのように規制していくのかについて注目が集まる中、米国FDAがこれまでよりもさらに一歩踏み込んだスタンスをこのほど示しました。
例えば、承認されたアプリの適応やバリデーション法を変えずに市販後にリアルワールドデータの機械学習の結果、性能が向上しているような場合、FDAの審査は不要だとしています。1つのスマートフォン上で動くアプリが承認を受けた場合に、別のスマホにも搭載する場合も、SPSやACPを変えず適切に実施すれば追加の審査は不要となります。
特に皮膚癌診断アプリの事例は、JOMDDは皮膚疾患の診断用アプリを開発している(株)エクスメディオを応援していますので(https://jomdd.com/2019/04/2340.html)個人的にも注目しました。上述の皮膚癌診断アプリの事例によると、医家向けで開発しているアプリの性能をAI/MLでアップデートを行っても問題ないものの、同じアプリを患者向けにリリースする場合は審査の対象となります。エクスメディオ社は現在、Doctor to Doctorのサービスしか展開していませんが、例えばAI/MLを用いて性能を強化するような開発を行ったとした場合の対応には規制がどうなるのか以前から興味を持っていました。そして、FDAは今回さらに一歩進んで、医家向けから患者向けという場合についてもスタンスを示しました。このようなプログラムが規制側からどう扱われるのか、今回のFDAの方針提示により、世界がどのように進んでいくのか、少しだけ方向性が見えたような気がします。
なお、あまりディスカッションペーパーの内容自体とは関係が無く、あくまで個人的な感想ですが、最近のFDAは以前よりもずっと国際整合に尽力していると感じています。今回のリリースを含めてデジタルヘルスの取り扱い方については、The International Medical Device Regulators Forum (IMDRF)との協調姿勢がよく見てとれます。これもグローバル化の所以だと思いますが、同時に、日本の審査レベルの向上や欧州の規制の厳格化も影響しているのかもしれません。そのようなことを感じました。
最後に、このブログはディスカッションペーパーを完全に訳しているわけではなく、内容を一部割愛するとともに、個人の見解の追記や、意訳部分がございます。ご了承くださいませ。さらに、今回のディスカッションペーパーですが、まだパブリックコメントも済んでいません。法的効力はなく、その上FDAは自らパブリックに対して多くの質問をしており、フィードバックを求めています。いずれ、法の整備も含めて新たな規制が実施されることと思います。
AI/MLの進歩が医療にもたらすインパクトは益々大きなものになっていくことは間違いないでしょう。産官学一体となって、このディスカッションペーパーとパブリックコメントを有効利用してもらいたいものです。患者さんや社会にとってより良い医療が実現するように、AI/MLの医療分野の規制が良い方向に整備されていくことを心から期待しつつ、今後の動向を継続的に注目して参りたいと思います。
¹ FDA, “Proposed Regulatory Framework for Modifications to Artificial
Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device
(SaMD) – Discussion Paper and Request for Feedback”, April 2019
https://www.fda.gov/downloads/MedicalDevices/DigitalHealth/SoftwareasaMedicalDevice/UCM635052.pdf
² FDA, “Digital Health Innovation Action Plan” , July 2017
https://www.fda.gov/downloads/MedicalDevices/DigitalHealth/UCM568735.pdf
³ FDA, “Developing a Software Precertification Program: A Warking Model”, Version 1.0, January 2019
https://www.fda.gov/downloads/MedicalDevices/DigitalHealth/DigitalHealthPreCertProgram/UCM629276.pdf